LA POLARIDAD DE LOS ENLACES COVALENTES y su relación con la miscibilidad
¿Alguna vez te preguntaste por qué algunas sustancias pueden mezclarse entre sí y por qué otras no pueden? La respuesta está en la polaridad de los enlaces químicos.
¿Por qué se mezclan las sustancias entre sí?
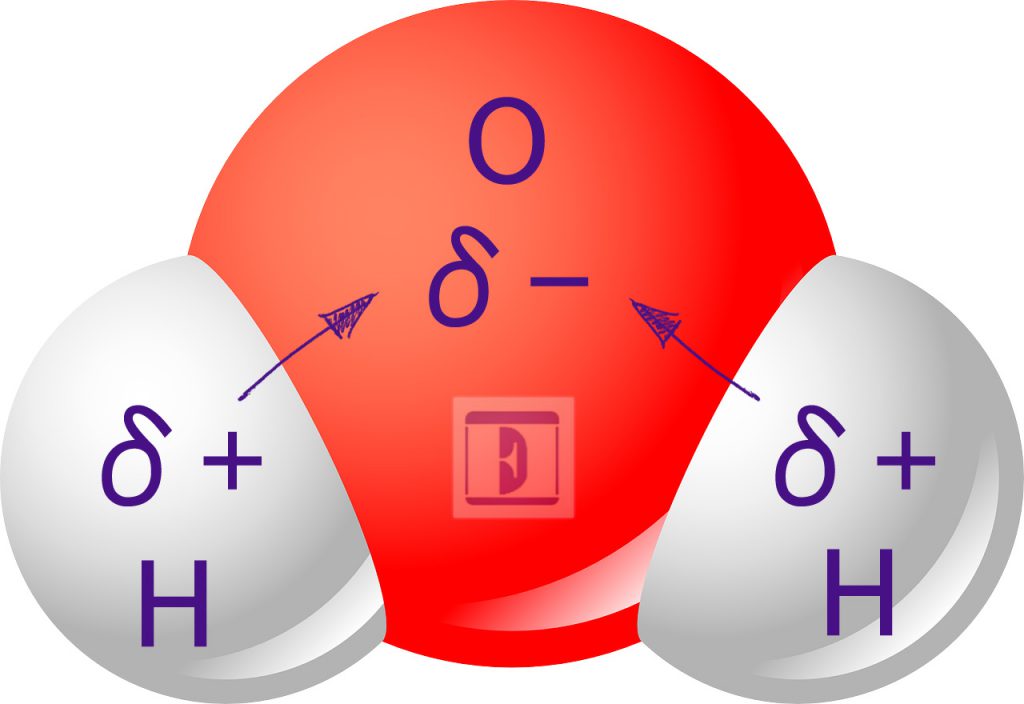
Sucede que, en una molécula, los electrones compartidos entre átomos son atraídos por los núcleos de dichos átomos. Si la intensidad de las fuerzas de atracción ejercidas por ambos núcleos son iguales, la molécula es no polar (o apolar). Si cuando uno de los átomos atrae con mayor intensidad a los electrones compartidos, la molécula es polar. Veamos con más detalle qué significa todo esto:
El concepto de miscibilidad
En sencillo términos, estamos en condiciones de decir que las sustancias polares sólo son capaces de disolver sustancias que también sean polares. Asimismo, las sustancias no polares pueden disolverse fácilmente en sustancias no polares. ¿Ves la utilidad de conocer la polaridad de los enlaces para predecir si dos sustancias son capaces de mezclarse entre ellas?

“Lo polar se disuelve en lo polar y no polar se disuelve en lo no polar”
Ésta es la razón por la que el azúcar puede disolverse en agua: ambas sustancias son polares y son miscibles entre ellas. En cambio, el aceite y el agua no presentan miscibilidad entre ellos. ¿Vas captando los conceptos de “miscible” y “no miscible”? Sucede que el agua es polar, pero el aceite no lo es (es apolar). Por otro lado, existe una sustancia química muy común en los laboratorios de escuela (pues sirve para explicar conceptos relacionados con polaridad de enlaces y miscibilidad) que es el tetracloruro de carbono, cuya fórmula química es \(CCl_4\). Este compuesto es apolar, al igual que el aceite. Por lo tanto, ambas sustancias son miscibles entre ellas (es decir, pueden mezclarse fácilmente formando una solución).
¿Qué es una solución?
Una solución es una mezcla homogénea formada por un soluto y un solvente. El solvente es la sustancia que disuelve. El soluto es la sustancia que se disuelve en el solvente. Así, cuando mezclamos sal en agua, se forma una solución compuesta por un solvente (el agua) y un soluto (la sal).
Polaridad de los enlaces covalentes
La unión química covalente que se da entre átomos de diferente electronegatividad recibe el nombre de unión covalente polar. Por otro lado, la unión química covalente que se da entre dos átomos del mismo elemento o de distintos elementos con valores de electronegatividad muy similares reciben el nombre de de unión covalente no polar.
Ejemplos de Uniones Covalentes Polares y No Polares
Un ejemplo de unión covalente polar es la que se establece en el fluoruro de hidrógeno (cuya fórmula es HF). En este caso, el par de electrones compartidos está desplazado hacia el flúor.
Por otra parte, ejemplos de uniones covalentes no polares son el dióxido de carbono (de fórmula muy conocida: CO2), el metano (presente en el gas de la cocina, de fórmula CH4) o la molécula de flúor (F2).
Te recomendamos leer nuestro artículo pilar sobre uniones covalentes para comprender mejor la polaridad de los enlaces, clickeando en:
https://www.ensambledeideas.com/uniones-quimicas-metalicas-ionicas-y-covalentes
Curiosidades: ¿el agua y el aceite se pueden mezclar?
Hasta aquí, han aprenddo que lo polar disuelve a lo polar y lo no polar a lo no polar. El agua es polar, por eso disuelve al azúcar, que también lo es. Pero el aceite es no polar y era imposible de disolver en agua. Hasta ahora. En condiciones extremas, ambas sustancias serían miscibles[note]que se pueden disolver entre ellas[/note], según explica un estudio publicado en ‘Science Advances‘.
El agua y el aceite no se llevan bien desde tiempos inmemoriables. Y es que uno no se puede disolver en el otro, como sí pueden hacerlo el azúcar y el agua o el agua y el alcohol. Un grupo de investigadores de la Universidad de Edimburgo, ha logrado lo que nadie: mezclar agua y aceite. Eso sí, ¡a presiones altísimas!

“Las sustancias repelentes se comportan bajo altas presiones, como las que se encuentran en el suelo oceánico o dentro de los planetas, lo que podría tener una enorme variedad de aplicaciones, desde reemplazar disolventes industriales caros y ambientalmente peligrosos hasta modelar cuerpos planetarios como la luna más grande de Saturno, Titán.”
John Loveday, del Centro para la Ciencia en las Condiciones Extremas de la Escuela de Física y Astronomía de la Universidad de Edimburgo
En su investigación, los científicos aplicaron alta presión a pequeños recipientes que contenían agua y metano, el gas de la cocina (una molécula apolar), sometiéndolos a presiones tan altas que se comparan con las que existen en el fondo oceánico, unos 20.000 bar (19738 atm aproximadamente, casi unas 20000 veces más que la presión atmosférica que sentimos a nivel del mar). El estudio fue apoyado por el Consejo de Investigación de Ingeniería y Ciencias Físicas y el Consejo Europeo de Investigación.
El equipo halló que las gotas de metano,a altas presiones, se habían disuelto en el agua, por lo que esto indicaría que otras moléculas apolares (como el aceite) también podrían disolverse en agua a presiones similares.
Una explicación podría ser que las moléculas de metano se contraen a medida que aumenta la presión, mientras que las moléculas de agua siguen, en su mayoría, iguales. Esto haría que las moléculas de metano comprimidas quepan entre las moléculas de agua más grandes, haciendo posible la disolución.
Para conocer más:
Te sugerimos la lectura de:
https://www.ensambledeideas.com/uniones-quimicas-metalicas-ionicas-y-covalentes
- El portal Educ.ar del Ministerio de Educación de la Nación Argentina ha lanzado un artículo propio sobre uniones covalentes y polaridad de los enlaces, con actividades de NTICx en el Software Avogadro. El artículo puede ser encontrado en: https://www.educ.ar/recursos/15086/uniones-covalentes-iii-polaridad-de-enlaces-y-moleculas/fullscreen/fullscreen
