Ecuaciones de formación de IONES explicada fácil
Antes de empezar, date una vuelta por el artículo “IONES” para comprender mejor los conceptos.
Las ecuaciones de formación de iones
En esta entrada, vamos a estudiar cómo armar las reacciones de formación de iones y de átomos neutros a partir de iones. No se asusten, no es un tema complicado de entender una vez que le hayan agarrado la mano.
Comencemos, ante todo, recordando que:
- Un anión es un átomo con carga eléctrica negativa, debido a que el átomo neutro “ganó” electrones.
- Un catión es un átomo con carga eléctrica positiva, debido a que el átomo neutro “perdió” electrones.
- La simbología correcta de un átomo neutro es:
- La simbología correcta de un catión es:

- La simbología correcta de un anión es:

En resumen:
| Si un átomo neutro “pierde” electrones es un catión, que tiene carga positiva. |
| Si un átomo neutro “gana” electrones es un anión, que tiene carga negativa. |
Una vez hecho esto, comencemos.
¿Qué es una reacción de formación? Una reacción de formación representa (en el papel, por ejemplo) cómo se forma un ion -o un átomo neutro a partir de iones-, mediante la “pérdida” o “ganancia” de electrones.
Formación de un Anión.
Estudiemos el caso de la formación de un anión:
Un anión, dijimos, se forma cuando un átomo neutro “gana” electrones. ¡Sí, ya sabemos que lo hemos dicho un montón de veces! Pero, créannos, es necesario tenerlo bien en claro.
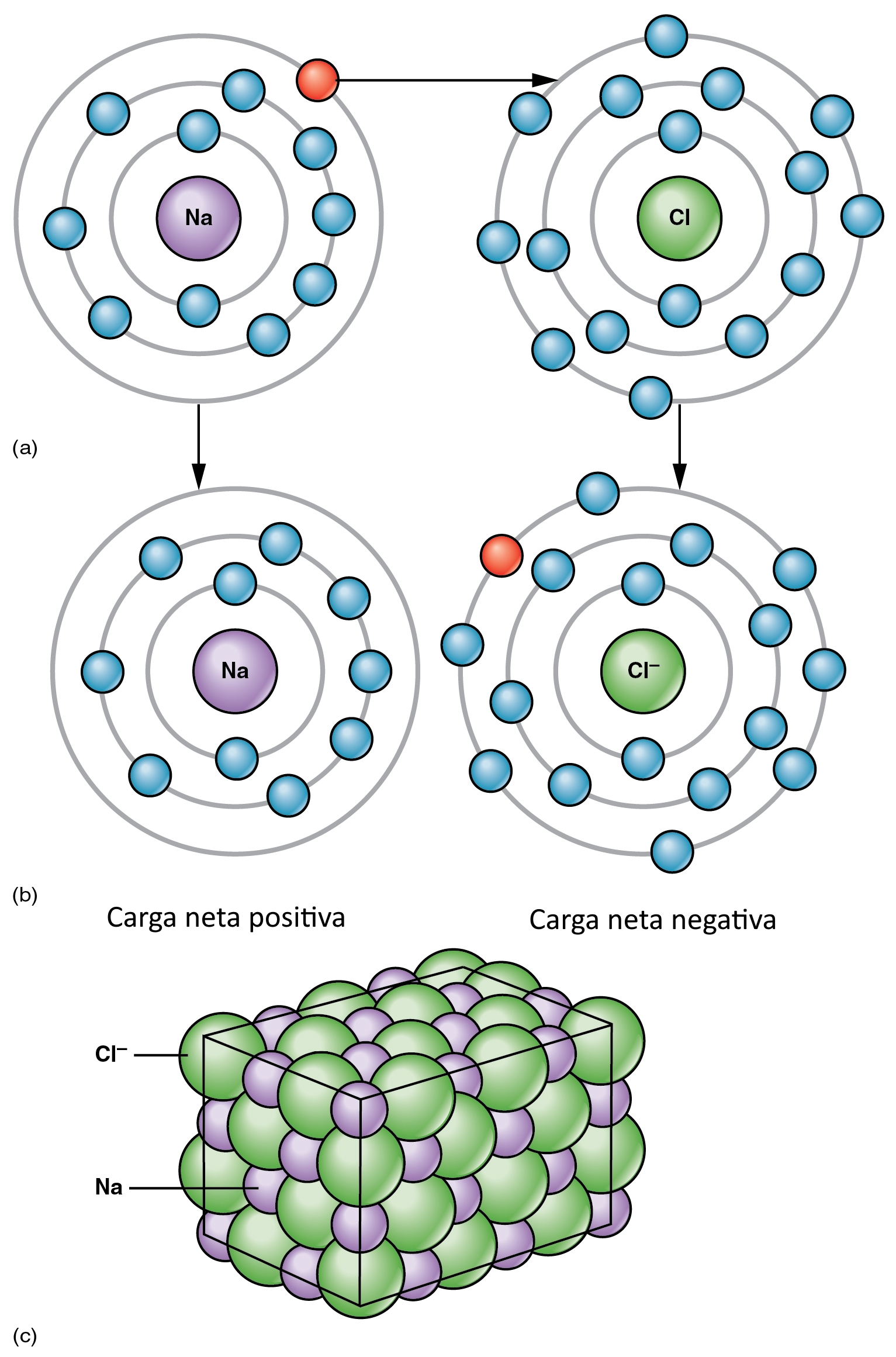
Explicaremos mejor el tema mediante un ejemplo. Supongamos que tenemos el átomo de cloro:

El átomo de cloro es capaz de “ganar” un electrón. Por lo que forma un anión cuyas características son:
| Nombre: ANIÓN CLORURO[note]Es común nombrar a los aniones colocando el sufijo -URO[/note] |
Símbolo: \( _{17}^{35}\textrm{Cl}^{-}\) |
| Número Atómico: 17 |
| Número Másico: 35 |
| Cantidad de protones: 17 |
| Cantidad de electrones: 18 |
| Cantidad de neutrones: 18 |
La cantidad de protones no es la misma que la cantidad de electrones. De hecho, hay más cantidad de electrones que de protones, por lo que nuestro ion es negativo. Como vemos, posee 17 protones y 18 electrones; es decir, el átomo de cloro “ganó” un electrón, formando nuestro anión. Esto se representará mediante una ecuación, una reacción como la siguiente:

¿Qué fue lo que hicimos? Atención. En la reacción anterior, se observa que:
El cloro neutro (escribiremos el símbolo del cloro, “Cl”)…
…ha ganado un electrón (se indica escribiendo: ” + 1 e– “)…
…formando entonces (esto se indica con una flecha)…
…al anión cloruro (colocamos Cl– después de la flecha).
Hasta aquí, no hay mucha dificultad, por lo que… ¡Felicitaciones! Ya hemos aprendido a escribir las ecuaciones de formación de un anión.
Estudiemos el caso de la formación de un catión:
Formación de un Catión.
Un catión, dijimos, se forma cuando un átomo neutro “pierde” electrones.
Explicaremos mejor el tema mediante un ejemplo. Supongamos que tenemos el átomo de sodio.
El átomo de sodio es capaz de perder un electrón. Por lo que forma un catión sodio cuyas características son:
| Nombre: CATIÓN SODIO |
| Símbolo: \( _{11}^{23}\textrm{Na}^{-}\) |
| Número Atómico: 11 |
| Número Másico: 23 |
| Cantidad de protones: 11 |
| Cantidad de electrones: 10 |
| Cantidad de neutrones: 12 |
Como vemos, posee 11 protones y 10 electrones; es decir, el átomo de sodio “perdió” un electrón, formando nuestro catión. Esto se representará mediante una ecuación, una reacción como la siguiente:

¡Vayamos más despacio! ¿Qué hemos hecho? Analicemos mejor la reacción. Del lado izquierdo, tenemos a nuestro sodio neutro. Luego de la reacción, es decir a la derecha, se ha formado un catión sodio, pero se se desprende un electrón. En otras palabras, es el caso contrario a la formación de aniones. En vez de ganar un electrón, el sodio lo pierde, pero no podremos escribirlo de la siguiente forma:

NUNCA se deben colocar signos “-” en las ecuaciones, es decir, no se puede restar. Si bien parece correcto, constituye un grave error. ¿Cómo hacemos, entonces, para indicar que un átomo perdió electrones? Lo colocamos a la derecha de la flecha, como si el electrón quedara completamente aparte (desvinculado) tanto del sodio como su catión. De esta forma, nos queda:

Formación de un átomo neutro a partir de un catión
¿Qué pasa si queremos formar un átomo neutro a partir de un catión? Véamoslo con este ejemplo:
El catión magnesio tiene 12 protones y 10 electrones. Esto indica que, obviamente, su carga es positiva y necesita “ganar” electrones para neutralizar las cargas positivas que tiene de más. De esta forma, si el catión magnesio “gana” 2 electrones, obtendremos un átomo neutro de magnesio.
Analicemos la oración anterior palabra por palabra:
Si el catión magnesio (escribiremos el símbolo del catión magnesio “Mg2+ “)…
…”gana” 2 electrones (se indica escribiendo: ” + 2 e– “)…
…obtendremos (esto se indica con una flecha)…
…un átomo neutro de magnesio (colocamos Mg después de la flecha).
Es decir:
Mg2+ + 2 e– → Mg
Formación de un átomo neutro a partir de un anión
¿Qué pasa si queremos formar un átomo neutro a partir de un anión? Véamoslo con este ejemplo:
El anión de azufre [note]Anión sulfuro es el nombre que recibe el anión del azufre[/note]tiene 16 protones y 18 electrones. Esto indica que, obviamente, su carga es negativa y necesita “perder” electrones para neutralizar las cargas positivas que tiene de más. De esta forma, si el anión de azufre “pierde” 2 electrones, obtendremos un átomo neutro de azufre.
Acá lo importante será tener en cuenta que si pierde electrones, NO podremos colocarlo del lado izquierdo de la flecha. Deberemos estar atentos a que estos electrones ya no pertenecen más al anión, el cual ahora es un átomo neutro. Por ello, deberemos colocarlo del lado derecho de la flecha, como si se hubiesen “desprendido” de su partícula.
Es decir, la forma correcta será:
S2- → S + 2 e–
El significado de “monovalente”, “divalente”…
Un poco más de vocabulario y terminamos:
- Cuando un átomo ha “perdido” un electrón, se dice que el catión formado es monovalente. Asimismo, si un átomo ha “ganado” un electrón, se dice que el anión formado es monovalente.
- Cuando un átomo ha “perdido” dos electrones, se dice que el catión formado es divalente. Asimismo, si un átomo ha “ganado” dos electrones, se dice que el anión formado es divalente.
- Cuando un átomo ha “perdido” tres electrones, se dice que el catión formado es trivalente.
Según esto, nos queda que:

es un catión sodio monovalente.

es un anión de cloro monovalente. Lo correcto es decir “anión cloruro monovalente”.

es un anión de selenio divalente. Lo correcto es decir “anión seleniuro divalente”.

es un catión magnesio divalente.
Ahora sí, ¡a practicar!
Actividades:
- Escribe la reacción de formación del anión sulfuro S2-
- Escribe la reacción de formación del catión bario Ba2+
- Escribe la reacción de formación del átomo de Oxígeno a partir del ion O2-
Por úlitmo, te dejemos este vídeo de nuestro canal de YouTube llamado “De qué hablamos cuando decimos iones“, que seguro te ayudará a comprender aún más esta explicación.
Ecuaciones de formación de IONES – Ensamble de Ideas – Copyright MMXXII
